《2022年高考化學(xué)二輪復(fù)習(xí) 選擇題專項(xiàng)訓(xùn)練5 實(shí)驗(yàn)分析型》由會(huì)員分享����,可在線閱讀�,更多相關(guān)《2022年高考化學(xué)二輪復(fù)習(xí) 選擇題專項(xiàng)訓(xùn)練5 實(shí)驗(yàn)分析型(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1�����、2022年高考化學(xué)二輪復(fù)習(xí) 選擇題專項(xiàng)訓(xùn)練5 實(shí)驗(yàn)分析型
1.向盛有Cl2的三個(gè)集氣瓶甲�����、乙、丙中各加入下列液體中的一種,經(jīng)振蕩,現(xiàn)象如下圖所示,則甲�、乙、丙中注入的液體分別是( )
①AgNO3溶液?��、贜aOH溶液?���、鬯?
A.①②③ B.②①③ C.③②① D.①③②
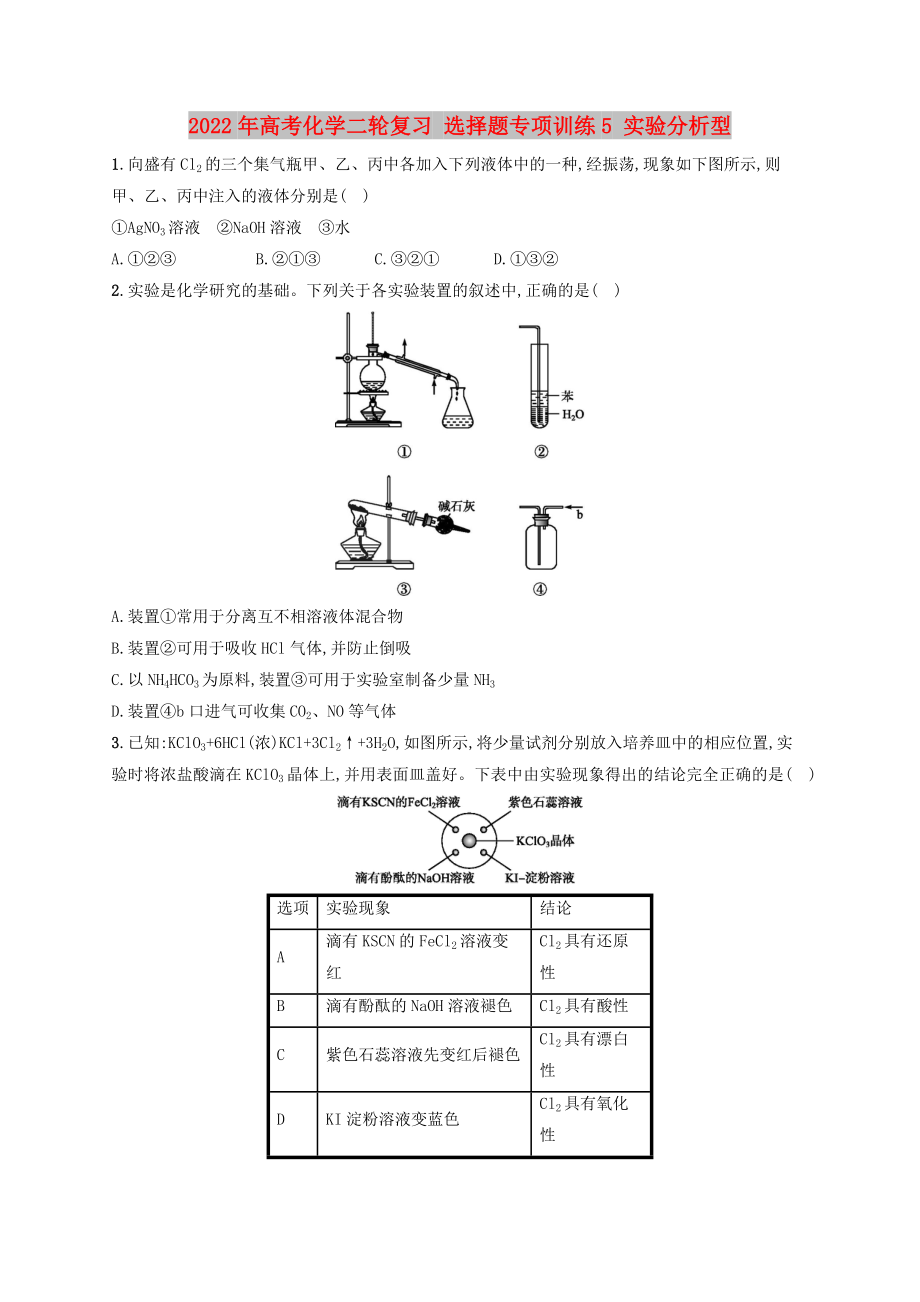
2.實(shí)驗(yàn)是化學(xué)研究的基礎(chǔ)��。下列關(guān)于各實(shí)驗(yàn)裝置的敘述中,正確的是( )
A.裝置①常用于分離互不相溶液體混合物
B.裝置②可用于吸收HCl氣體,并防止倒吸
C.以NH4HCO3為原料,裝置③可用于實(shí)驗(yàn)室制備少量NH3
D.裝置④b口進(jìn)氣可收集CO2��、NO等氣體
3.已知:KClO3+6HCl(濃)KCl+3
2��、Cl2↑+3H2O,如圖所示,將少量試劑分別放入培養(yǎng)皿中的相應(yīng)位置,實(shí)驗(yàn)時(shí)將濃鹽酸滴在KClO3晶體上,并用表面皿蓋好�。下表中由實(shí)驗(yàn)現(xiàn)象得出的結(jié)論完全正確的是( )
選項(xiàng)
實(shí)驗(yàn)現(xiàn)象
結(jié)論
A
滴有KSCN的FeCl2溶液變紅
Cl2具有還原性
B
滴有酚酞的NaOH溶液褪色
Cl2具有酸性
C
紫色石蕊溶液先變紅后褪色
Cl2具有漂白性
D
KI淀粉溶液變藍(lán)色
Cl2具有氧化性
4.下列根據(jù)實(shí)驗(yàn)操作和現(xiàn)象所得出的結(jié)論正確的是( )
選項(xiàng)
實(shí)驗(yàn)操作
實(shí)驗(yàn)現(xiàn)象
結(jié)論
A
向鹽酸酸化的Ba(NO3)2溶液中通入SO2
有白色沉淀生成
BaSO3
3����、難溶于酸
B
向溶液X中滴加稀NaOH溶液,將濕潤(rùn)紅色石蕊試紙置于試管口
試紙不變藍(lán)
原溶液中無(wú)N
C
向FeBr2溶液中加入少量氯水,再加CCl4萃取
CCl4層無(wú)色
Fe2+的還原性強(qiáng)于Br-
D
向淀粉溶液中加入稀硫酸,加熱幾分鐘,冷卻后再加入新制Cu(OH)2,加熱
沒有紅色沉淀生成
淀粉沒有水解生成葡萄糖
5.下列有關(guān)實(shí)驗(yàn)原理或?qū)嶒?yàn)操作正確的是( )
A.用甲裝置驗(yàn)證銅與稀硝酸的反應(yīng)產(chǎn)物是NO
B.通過乙裝置實(shí)現(xiàn)化學(xué)反應(yīng):2Cu+O2+4H+2Cu2++2H2O
C.用適量銅粉除去CuCl2溶液中少量的FeCl3
D.在乙酸乙酯樣品中加入適量
4、的乙醇加熱,可除去其中混有的少量乙酸
6.在5 mL 0.1 mol·L-1 KI溶液中滴加0.1 mol·L-1 FeCl3溶液5~6滴后,再進(jìn)行下列實(shí)驗(yàn),其中可證明FeCl3和KI的反應(yīng)是可逆反應(yīng)的實(shí)驗(yàn)(含現(xiàn)象)是( )
A.滴加AgNO3溶液,觀察有黃色沉淀產(chǎn)生
B.加CCl4振蕩后,下層液體為淺紫色
C.加入CCl4振蕩,下層液體為淺紫色;取上層清液,滴加AgNO3溶液,有白色沉淀產(chǎn)生
D.加入CCl4振蕩后,下層液體為淺紫色;取上層清液,滴加KSCN溶液,溶液顯紅色
選擇題專項(xiàng)訓(xùn)練五 實(shí)驗(yàn)分析型
1.B 解析:氯氣與AgNO3溶液��、NaOH溶液���、水作
5�����、用時(shí)的現(xiàn)象分別為生成白色沉淀AgCl;生成NaCl�����、NaClO;與水形成淺黃綠色的新制氯水���。因此結(jié)合題中現(xiàn)象與選項(xiàng)可知B項(xiàng)正確���。
2.C 解析:A項(xiàng),裝置①為蒸餾裝置,主要用于分離不同沸點(diǎn)的互溶液體混合物;B項(xiàng),HCl極易溶于水,會(huì)發(fā)生倒吸;C項(xiàng),堿石灰吸收產(chǎn)生的CO2和H2O(g),可制得純凈干燥的NH3;D項(xiàng),由于CO2密度比空氣密度大,導(dǎo)管應(yīng)長(zhǎng)進(jìn)短出,而NO不能用排空氣法收集。
3.D 解析:A項(xiàng)是因?yàn)镃l2具有強(qiáng)氧化性;Cl2本身沒有酸性,Cl2與水反應(yīng)生成HCl和HClO,再與NaOH溶液發(fā)生中和反應(yīng)生成鹽而使溶液褪色,B項(xiàng)錯(cuò);Cl2本身不具有漂白性,而是Cl2與H2O作用生成的
6���、HClO具有漂白性,C項(xiàng)錯(cuò)���。
4.C 解析:A項(xiàng),酸性條件下N氧化SO2,故最終白色沉淀為BaSO4,錯(cuò)誤;B項(xiàng),實(shí)驗(yàn)采用稀NaOH溶液且沒有加熱,不能生成NH3,錯(cuò)誤;C項(xiàng),無(wú)Br2生成,Cl2少量時(shí)先氧化Fe2+,正確;D項(xiàng),反應(yīng)需要在堿性條件下進(jìn)行,需要先加堿中和硫酸,錯(cuò)誤。
5.B 解析:A項(xiàng),NO2能與水反應(yīng)生成NO;B項(xiàng),銅比C活潑,失去電子而作負(fù)極,O2在酸性條件下得電子生成H2O,右側(cè)通入N2,目的是將b燒杯中的O2驅(qū)除,以免O2和Cu及HCl在b燒杯中反應(yīng),正確;C項(xiàng),銅粉與FeCl3反應(yīng)后有FeCl2雜質(zhì);D項(xiàng),乙醇與乙酸生成乙酸乙酯屬于可逆反應(yīng),故無(wú)法徹底除去乙酸���。
6.D 解析:溶液混合后發(fā)生反應(yīng)2I-+2Fe3+2Fe2++I2,結(jié)合題中數(shù)據(jù)可知若反應(yīng)不是可逆反應(yīng),則混合液中不存在Fe3+,向反應(yīng)后的溶液中加入CCl4萃取出反應(yīng)生成的I2后,再向上層清液中加入KSCN溶液,若看到溶液顯紅色說明溶液中含有Fe3+,從而證明I-與Fe3+的反應(yīng)為可逆反應(yīng)����。
 2022年高考化學(xué)二輪復(fù)習(xí) 選擇題專項(xiàng)訓(xùn)練5 實(shí)驗(yàn)分析型
2022年高考化學(xué)二輪復(fù)習(xí) 選擇題專項(xiàng)訓(xùn)練5 實(shí)驗(yàn)分析型