《高考化學(xué)一輪精習(xí)題 第2章 化學(xué)物質(zhì)及其變化7含解析》由會(huì)員分享��,可在線閱讀�,更多相關(guān)《高考化學(xué)一輪精習(xí)題 第2章 化學(xué)物質(zhì)及其變化7含解析(2頁珍藏版)》請?jiān)谘b配圖網(wǎng)上搜索。
1��、
第2章化學(xué)物質(zhì)及其變化(7)
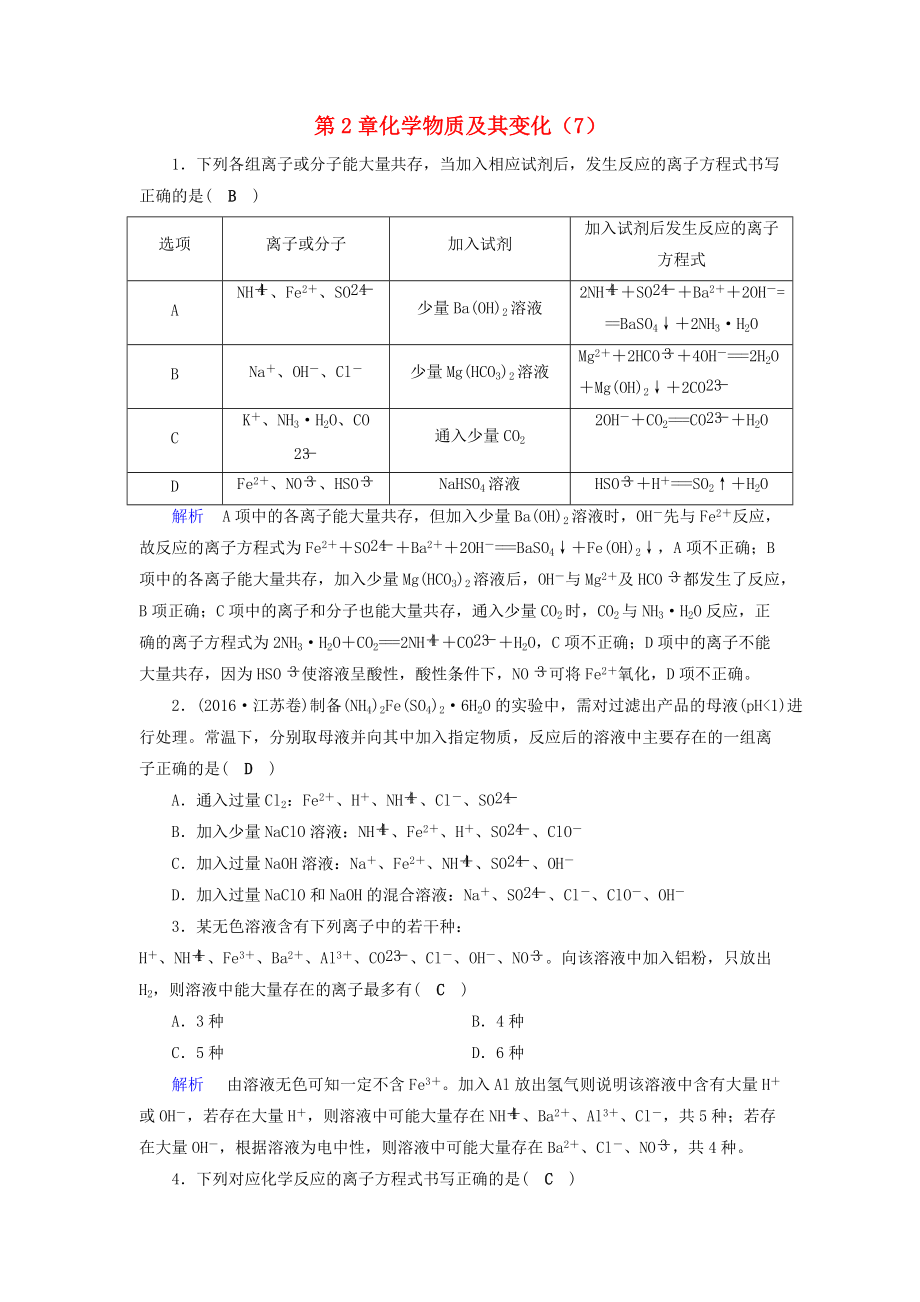
1.下列各組離子或分子能大量共存�����,當(dāng)加入相應(yīng)試劑后�,發(fā)生反應(yīng)的離子方程式書寫正確的是( B )
選項(xiàng)
離子或分子
加入試劑
加入試劑后發(fā)生反應(yīng)的離子方程式
A
NH、Fe2+�、SO
少量Ba(OH)2溶液
2NH+SO+Ba2++2OH-===BaSO4↓+2NH3H2O
B
Na+、OH-�、Cl-
少量Mg(HCO3)2溶液
Mg2++2HCO+4OH-===2H2O+Mg(OH)2↓+2CO
C
K+、NH3H2O�、CO
通入少量CO2
2OH-+CO2===CO+H2O
D
Fe2+�、NO����、HSO
NaHSO4溶液
2、
HSO+H+===SO2↑+H2O
解析 A項(xiàng)中的各離子能大量共存��,但加入少量Ba(OH)2溶液時(shí)���,OH-先與Fe2+反應(yīng)��,故反應(yīng)的離子方程式為Fe2++SO+Ba2++2OH-===BaSO4↓+Fe(OH)2↓�����,A項(xiàng)不正確�;B項(xiàng)中的各離子能大量共存���,加入少量Mg(HCO3)2溶液后��,OH-與Mg2+及HCO都發(fā)生了反應(yīng)�����,B項(xiàng)正確�;C項(xiàng)中的離子和分子也能大量共存,通入少量CO2時(shí)����,CO2與NH3H2O反應(yīng),正確的離子方程式為2NH3H2O+CO2===2NH+CO+H2O�,C項(xiàng)不正確;D項(xiàng)中的離子不能大量共存��,因?yàn)镠SO使溶液呈酸性�����,酸性條件下����,NO可將Fe2+氧化���,D項(xiàng)不正確��。
2
3�����、.(2016江蘇卷)制備(NH4)2Fe(SO4)26H2O的實(shí)驗(yàn)中��,需對過濾出產(chǎn)品的母液(pH<1)進(jìn)行處理�。常溫下,分別取母液并向其中加入指定物質(zhì)�����,反應(yīng)后的溶液中主要存在的一組離子正確的是( D )
A.通入過量Cl2:Fe2+�����、H+�����、NH�、Cl-、SO
B.加入少量NaClO溶液:NH��、Fe2+���、H+����、SO、ClO-
C.加入過量NaOH溶液:Na+��、Fe2+���、NH���、SO、OH-
D.加入過量NaClO和NaOH的混合溶液:Na+���、SO�����、Cl-、ClO-�、OH-
3.某無色溶液含有下列離子中的若干種:H+、NH�����、Fe3+�����、Ba2+����、Al3+���、CO、Cl-����、OH-、NO���。向該溶液
4��、中加入鋁粉�����,只放出H2��,則溶液中能大量存在的離子最多有( C )
A.3種 B.4種
C.5種 D.6種
解析 由溶液無色可知一定不含F(xiàn)e3+��。加入Al放出氫氣則說明該溶液中含有大量H+或OH-�����,若存在大量H+�����,則溶液中可能大量存在NH���、Ba2+�、Al3+�、Cl-,共5種���;若存在大量OH-����,根據(jù)溶液為電中性����,則溶液中可能大量存在Ba2+����、Cl-、NO�,共4種。
4.下列對應(yīng)化學(xué)反應(yīng)的離子方程式書寫正確的是( C )
A.用KIO3氧化酸性溶液中的KI:5I-+I(xiàn)O+3H2O===3I2+6OH-
B.向NH4HCO3溶液中加入過量NaOH溶液并加熱:NH+OH-NH
5、3↑+H2O
C.將過量SO2通入冷氨水中:SO2+NH3H2O===HSO+NH
D.Ba(OH)2溶液中逐滴加入一定物質(zhì)的量濃度的NaHSO4溶液�,當(dāng)溶液中的OH-恰好反應(yīng)一半時(shí):Ba2++2OH-+2H++SO===BaSO4↓+2H2O
6EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F375
 高考化學(xué)一輪精習(xí)題 第2章 化學(xué)物質(zhì)及其變化7含解析
高考化學(xué)一輪精習(xí)題 第2章 化學(xué)物質(zhì)及其變化7含解析