《高考化學(xué)總復(fù)習(xí) 熱點專題 物質(zhì)的量在化學(xué)方程式計算中的應(yīng)用熱點專題課件 新人教版》由會員分享�,可在線閱讀,更多相關(guān)《高考化學(xué)總復(fù)習(xí) 熱點專題 物質(zhì)的量在化學(xué)方程式計算中的應(yīng)用熱點專題課件 新人教版(29頁珍藏版)》請在裝配圖網(wǎng)上搜索���。
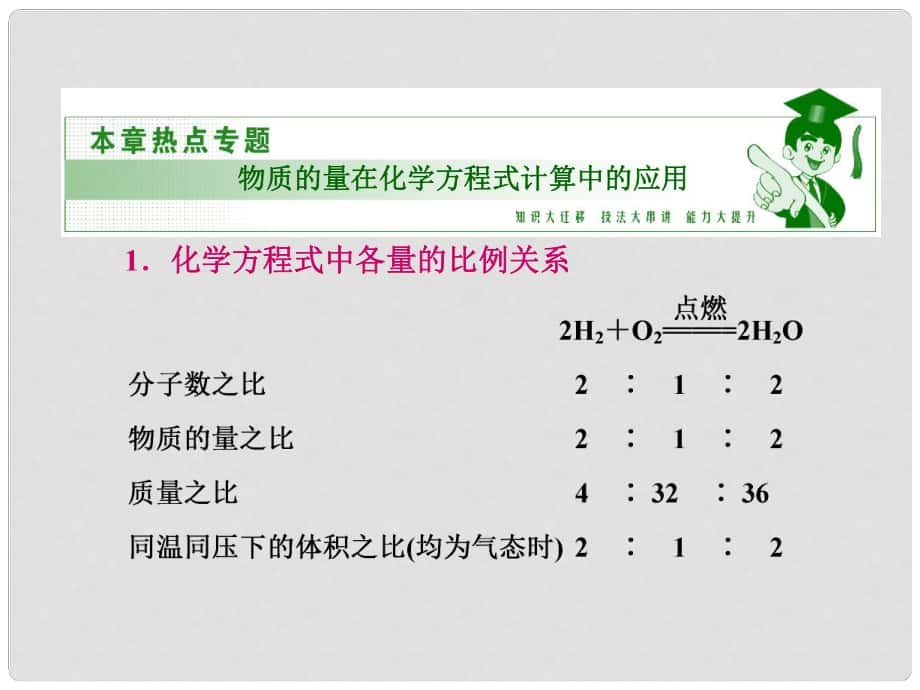
1����、物質(zhì)的量在化學(xué)方程式計算中的應(yīng)用物質(zhì)的量在化學(xué)方程式計算中的應(yīng)用1化學(xué)方程式中各量的比例關(guān)系化學(xué)方程式中各量的比例關(guān)系2常用化學(xué)計算的巧解方法常用化學(xué)計算的巧解方法(1)守恒法:守恒法: 例例138.4 mg銅跟適量的濃硝酸反應(yīng),銅全部作用后�,銅跟適量的濃硝酸反應(yīng),銅全部作用后����,共收集氣體共收集氣體22.4 mL(標(biāo)準(zhǔn)狀況標(biāo)準(zhǔn)狀況),反應(yīng)消耗�,反應(yīng)消耗HNO3的物質(zhì)的量的物質(zhì)的量可能是可能是 () A1.0103 molB1.6103 mol C2.2103 mol D2.4103 mol答案答案C(2)差量法:差量法:常用的有質(zhì)量差量法和體積差量法常用的有質(zhì)量差量法和體積差量法A10.6 g
2、 B5.3 gC5.9 g D無法計算無法計算由此建立關(guān)系:由此建立關(guān)系:Na2CO3Na2O2NaOHm1 mol 18 g a 29 g27.2 ga0.1 mol��,m(Na2CO3)10.6 g���。答案答案A (3)極值法:極值法: 極值法是利用極限思維方式解決一些模糊問題的解題極值法是利用極限思維方式解決一些模糊問題的解題技巧�,它是將題設(shè)構(gòu)造為問題的兩個極端�����,然后依據(jù)有關(guān)技巧�����,它是將題設(shè)構(gòu)造為問題的兩個極端,然后依據(jù)有關(guān)化學(xué)知識確定所需反應(yīng)物或生成物的極值��,進(jìn)行判斷分析化學(xué)知識確定所需反應(yīng)物或生成物的極值����,進(jìn)行判斷分析求出結(jié)果,具體解題思路為:求出結(jié)果����,具體解題思路為: 把可逆反應(yīng)假設(shè)成
3、為向某一方向進(jìn)行完全的反應(yīng)��。把可逆反應(yīng)假設(shè)成為向某一方向進(jìn)行完全的反應(yīng)�����。 把混合物假設(shè)成為某一純凈物����。把混合物假設(shè)成為某一純凈物�����。 把多個同時進(jìn)行的反應(yīng)假設(shè)成單一反應(yīng)。把多個同時進(jìn)行的反應(yīng)假設(shè)成單一反應(yīng)�。 例例3一定溫度下,在密閉容器中加入一定溫度下���,在密閉容器中加入I2蒸氣和蒸氣和H2各各0.5 mol�����,發(fā)生反應(yīng):發(fā)生反應(yīng): 達(dá)平衡時生成達(dá)平衡時生成0.8 mol HI氣體����,若在其他條件不變時��,開始?xì)怏w���,若在其他條件不變時����,開始加入加入2 mol氫氣���,則達(dá)到平衡時生成的氫氣��,則達(dá)到平衡時生成的HI可能為可能為 () A0.8 mol B0.9 mol C1.0 mol D1.4 mol 解析
4�����、解析根據(jù)化學(xué)平衡移動原理����,增大根據(jù)化學(xué)平衡移動原理,增大H2濃度��,化學(xué)平衡向濃度��,化學(xué)平衡向生成生成HI方向移動��,則生成的方向移動����,則生成的HI超過超過0.8 mol,又因為�,又因為I2只有只有0.5 mol,若全部反應(yīng)�����,最多只生成若全部反應(yīng)����,最多只生成1 mol HI,但這是不可能的�,所以,但這是不可能的��,所以0.8 moln(HI)ca2)�����,且有平均值且有平均值c的計算題���;的計算題�; b兩物質(zhì)所取的基準(zhǔn)量兩物質(zhì)所取的基準(zhǔn)量n1�、n2可相加;可相加���; c要有兩個組分量的平均值�����,且平均值的單位要與兩個組要有兩個組分量的平均值��,且平均值的單位要與兩個組分量所表示的單位相同���;分量所表示的單位相同����;
5����、 dn1/n2是所取的基準(zhǔn)量之比,即組分的單位中分母的單位��。是所取的基準(zhǔn)量之比���,即組分的單位中分母的單位��。 有關(guān)溶質(zhì)質(zhì)量分?jǐn)?shù)的計算:差值之比為溶液的質(zhì)量之比��;有關(guān)溶質(zhì)質(zhì)量分?jǐn)?shù)的計算:差值之比為溶液的質(zhì)量之比�����;有關(guān)物質(zhì)的量濃度的計算:差值之比為溶液的體積之比����;有關(guān)平有關(guān)物質(zhì)的量濃度的計算:差值之比為溶液的體積之比�����;有關(guān)平均相對分子質(zhì)量����、平均相對原子質(zhì)量的計算:差值之比為物質(zhì)的均相對分子質(zhì)量、平均相對原子質(zhì)量的計算:差值之比為物質(zhì)的量之比�;有關(guān)反應(yīng)熱的計算:差值之比為物質(zhì)的量之比;有關(guān)混量之比����;有關(guān)反應(yīng)熱的計算:差值之比為物質(zhì)的量之比;有關(guān)混合物反應(yīng)的計算��。合物反應(yīng)的計算�。 例例5體積為體積為1升
6、的干燥容器中充入升的干燥容器中充入HCl氣體后����,測得氣體后,測得容器中氣體對氧氣的相對密度為容器中氣體對氧氣的相對密度為1.082�����。將此氣體倒扣在水��。將此氣體倒扣在水中�,最終進(jìn)入容器中液體的體積是中�����,最終進(jìn)入容器中液體的體積是 () A0.25 LB0.5 L C0.75 L D1 L答案答案C 3過量問題的計算過量問題的計算 兩種反應(yīng)物的量均已知�,應(yīng)先判斷過量情況����,再根據(jù)沒有過兩種反應(yīng)物的量均已知,應(yīng)先判斷過量情況���,再根據(jù)沒有過量的反應(yīng)物的量進(jìn)行計算�,求出產(chǎn)物的量���,步驟為:量的反應(yīng)物的量進(jìn)行計算���,求出產(chǎn)物的量,步驟為:寫出反應(yīng)寫出反應(yīng)的化學(xué)方程式�;的化學(xué)方程式;判斷哪一種反應(yīng)物過量�;判斷哪一
7、種反應(yīng)物過量���;根據(jù)不足量的物質(zhì)根據(jù)不足量的物質(zhì)求解�����。求解�����。 確定某種物質(zhì)過量的方法:確定某種物質(zhì)過量的方法: 驗算法:根據(jù)反應(yīng)中某種反應(yīng)物或生成物的量�,再通過化驗算法:根據(jù)反應(yīng)中某種反應(yīng)物或生成物的量�����,再通過化學(xué)方程式中各物質(zhì)化學(xué)計量數(shù)間的比例關(guān)系驗算出其他反應(yīng)物所學(xué)方程式中各物質(zhì)化學(xué)計量數(shù)間的比例關(guān)系驗算出其他反應(yīng)物所需的量�����,并與給出的該物質(zhì)的量比較�。需的量,并與給出的該物質(zhì)的量比較����。 最大值法:如標(biāo)準(zhǔn)狀況下最大值法:如標(biāo)準(zhǔn)狀況下10 mL氣態(tài)烴在氣態(tài)烴在100 mL O2中燃燒,中燃燒��,10 mL氣態(tài)烴完全燃燒所需氣態(tài)烴完全燃燒所需O2的最大值的最大值V(O2)65 mL100 mL,故故
8�����、O2過量��。過量�����。 例例6在標(biāo)準(zhǔn)狀況下��,取甲�����、乙�、丙各在標(biāo)準(zhǔn)狀況下,取甲��、乙����、丙各30.0 mL相同相同濃度的鹽酸,然后分別慢慢加入組成相同的鎂鋁合金粉末��,濃度的鹽酸,然后分別慢慢加入組成相同的鎂鋁合金粉末�,得下表中有關(guān)數(shù)據(jù)得下表中有關(guān)數(shù)據(jù)(假設(shè)反應(yīng)前后溶液體積不發(fā)生變化假設(shè)反應(yīng)前后溶液體積不發(fā)生變化)。請回答:請回答:336336280氣體體積氣體體積/mL459385255合金質(zhì)量合金質(zhì)量/mg丙丙乙乙甲甲實驗序號實驗序號 (1)甲組實驗中���,鹽酸甲組實驗中�,鹽酸(選填選填“過量過量”�、“適量適量”或或“不足量不足量”,下同下同)_�����;乙組實驗中鹽酸����;乙組實驗中鹽酸_���。 (2)鹽酸的物質(zhì)的量濃度
9�����、為鹽酸的物質(zhì)的量濃度為_�����。 (3)合金中合金中Mg�、Al的物質(zhì)的量之比為的物質(zhì)的量之比為_。 解析解析(1)鹽酸的用量相同����,甲、乙對比��,甲中合金的質(zhì)鹽酸的用量相同����,甲、乙對比�����,甲中合金的質(zhì)量增大���,氣體體積增大���,說明甲組中合金不足,鹽酸過量���。量增大��,氣體體積增大�����,說明甲組中合金不足�,鹽酸過量。乙組中合金增重乙組中合金增重130 mg���,比甲組合金質(zhì)量的一半略大��,而氣����,比甲組合金質(zhì)量的一半略大��,而氣體體積增大體體積增大56 mL�����,遠(yuǎn)遠(yuǎn)小于甲組氣體的一半����,說明乙組鹽酸��,遠(yuǎn)遠(yuǎn)小于甲組氣體的一半,說明乙組鹽酸不足�����。不足���。 (2)鹽酸的濃度按乙組或丙組數(shù)據(jù)計算���,由守恒關(guān)系:鹽酸的濃度按乙組或丙組數(shù)據(jù)計算,由
10����、守恒關(guān)系:2HClH2,得�,得n(HCl)0.030 mol,c(HCl)1.0 molL1����。答案答案(1)過量不足量過量不足量(2)1.0 molL1(3)1 1針對訓(xùn)練針對訓(xùn)練1有某硫酸、硫酸亞鐵�、硫酸鐵混合溶液有某硫酸、硫酸亞鐵�、硫酸鐵混合溶液100 mL,已知�����,已知溶液中各陽離子的物質(zhì)的量濃度相等,硫酸根離子總?cè)芤褐懈麝栯x子的物質(zhì)的量濃度相等�,硫酸根離子總濃度為濃度為6 mol/L,此溶液中可溶解鐵粉的質(zhì)量為��,此溶液中可溶解鐵粉的質(zhì)量為()A10.6 gB11.2 gC33.6 g D5.6 g解析:電解質(zhì)溶液中�����,陽離子所帶的正電荷總數(shù)一定等解析:電解質(zhì)溶液中��,陽離子所帶的正電荷總數(shù)一
11����、定等于陰離子所帶的負(fù)電荷總數(shù),故本題可利用電荷守恒關(guān)于陰離子所帶的負(fù)電荷總數(shù)����,故本題可利用電荷守恒關(guān)系求解���。根據(jù)題意����,可設(shè)溶液系求解。根據(jù)題意�,可設(shè)溶液H、Fe2��、Fe3物質(zhì)的量物質(zhì)的量各為各為x���,根據(jù)電荷守恒:�����,根據(jù)電荷守恒:(123)x6 mol/L0.1 L2���,x0.2 mol,0.2 mol H可溶解可溶解(即反應(yīng)即反應(yīng))0.1 mol Fe,0.2 mol Fe3可溶解可溶解(即反應(yīng)即反應(yīng))0.1 mol Fe�����,所以此溶液共可溶解���,所以此溶液共可溶解Fe粉:粉:56 g/mol(0.1 mol0.1 mol)11.2 g���。答案:答案:B2(2010全國理綜全國理綜)在一定的溫度、壓強
12�、下����,向在一定的溫度���、壓強下�����,向100 mL CH4和和Ar的混合氣體中通入的混合氣體中通入400 mL O2�����,點燃使其完全����,點燃使其完全反應(yīng)��,最后在相同條件下得到干燥氣體反應(yīng)����,最后在相同條件下得到干燥氣體460 mL�����,則反應(yīng),則反應(yīng)前混合氣體中前混合氣體中CH4和和Ar的物質(zhì)的量之比為的物質(zhì)的量之比為 ()A1 4 B1 3C1 2 D1 1解析:根據(jù)解析:根據(jù)CH42O2=CO22H2O�,利用差量法,利用差量法����,1 mL CH4完全燃燒生成干燥的完全燃燒生成干燥的CO2時,混合氣體體積縮小時�,混合氣體體積縮小2 mL,現(xiàn)混合氣體體積縮小了�,現(xiàn)混合氣體體積縮小了40 mL,則�,則CH4為為20
13、 mL����,Ar為為80 mL。答案:答案:A3(2012石家莊第二次質(zhì)檢石家莊第二次質(zhì)檢)在在(NH4)2Fe(SO4)2溶液中逐滴加入溶液中逐滴加入100 mL 1 mol/L的的Ba(OH)2溶液���,把所得沉淀過濾��、洗滌����、溶液,把所得沉淀過濾�、洗滌、干燥�����,得到的固體質(zhì)量不可能是干燥�,得到的固體質(zhì)量不可能是 ()A35.3 g B33.5 gC32.3 g D11.3 g解析:解析:100 mL 1 mol/L Ba(OH)2溶液與足量溶液與足量(NH4)2Fe(SO4)2溶液反應(yīng),將所得沉淀過濾�、洗滌、干燥�,得到的固體質(zhì)溶液反應(yīng),將所得沉淀過濾����、洗滌、干燥�����,得到的固體質(zhì)量最大值為量最大值為0.
14�����、1 mol BaSO4與與0.1 mol Fe(OH)3的質(zhì)量之和即的質(zhì)量之和即34 g�,故�����,故A不可能。不可能����。答案:答案:A4一定體積的一定體積的KMnO4溶液恰好能氧化一定質(zhì)量的溶液恰好能氧化一定質(zhì)量的KHC2O4H2C2O42H2O。若用����。若用0.100 0 mol/L的的NaOH溶溶液中和相同質(zhì)量的液中和相同質(zhì)量的KHC2O4H2C2O42H2O,所需�����,所需NaOH溶液的體積恰好為溶液的體積恰好為KMnO4溶液的溶液的3倍��,則倍�����,則KMnO4溶液的溶液的濃度濃度(mol/L)為為 ()提示:提示:H2C2O4是二元弱酸是二元弱酸10KHC2O4H2C2O48KMnO417H2SO4= 8MnSO49K2SO440CO232H2OA0.00888 9 B0.080 00C0.120 0 D0.240 0解析:由提示解析:由提示知知答案:答案:B5下列兩個熱化學(xué)方程式:下列兩個熱化學(xué)方程式:2H2(g)O2(g)=2H2O(l)H571.6 kJ/molC3H8(g)5O2(g)=3CO2(g)4H2O(l)H2 220 kJ/mol實驗測知實驗測知H2和和C3H8的混合氣體的混合氣體5 mol完全燃燒時放熱完全燃燒時放熱3 847 kJ���,則混合氣體中��,則混合氣體中H2和和C3H8的物質(zhì)的量之比約為的物質(zhì)的量之比約為 ()答案:答案:B
 高考化學(xué)總復(fù)習(xí) 熱點專題 物質(zhì)的量在化學(xué)方程式計算中的應(yīng)用熱點專題課件 新人教版
高考化學(xué)總復(fù)習(xí) 熱點專題 物質(zhì)的量在化學(xué)方程式計算中的應(yīng)用熱點專題課件 新人教版