《人教版九年級(jí)下學(xué)期化學(xué) 第十單元 酸和堿 專(zhuān)項(xiàng) 中和反應(yīng)》由會(huì)員分享�,可在線(xiàn)閱讀,更多相關(guān)《人教版九年級(jí)下學(xué)期化學(xué) 第十單元 酸和堿 專(zhuān)項(xiàng) 中和反應(yīng)(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索���。
1���、人教版九下化學(xué) 第十單元 酸和堿 專(zhuān)項(xiàng) 中和反應(yīng)
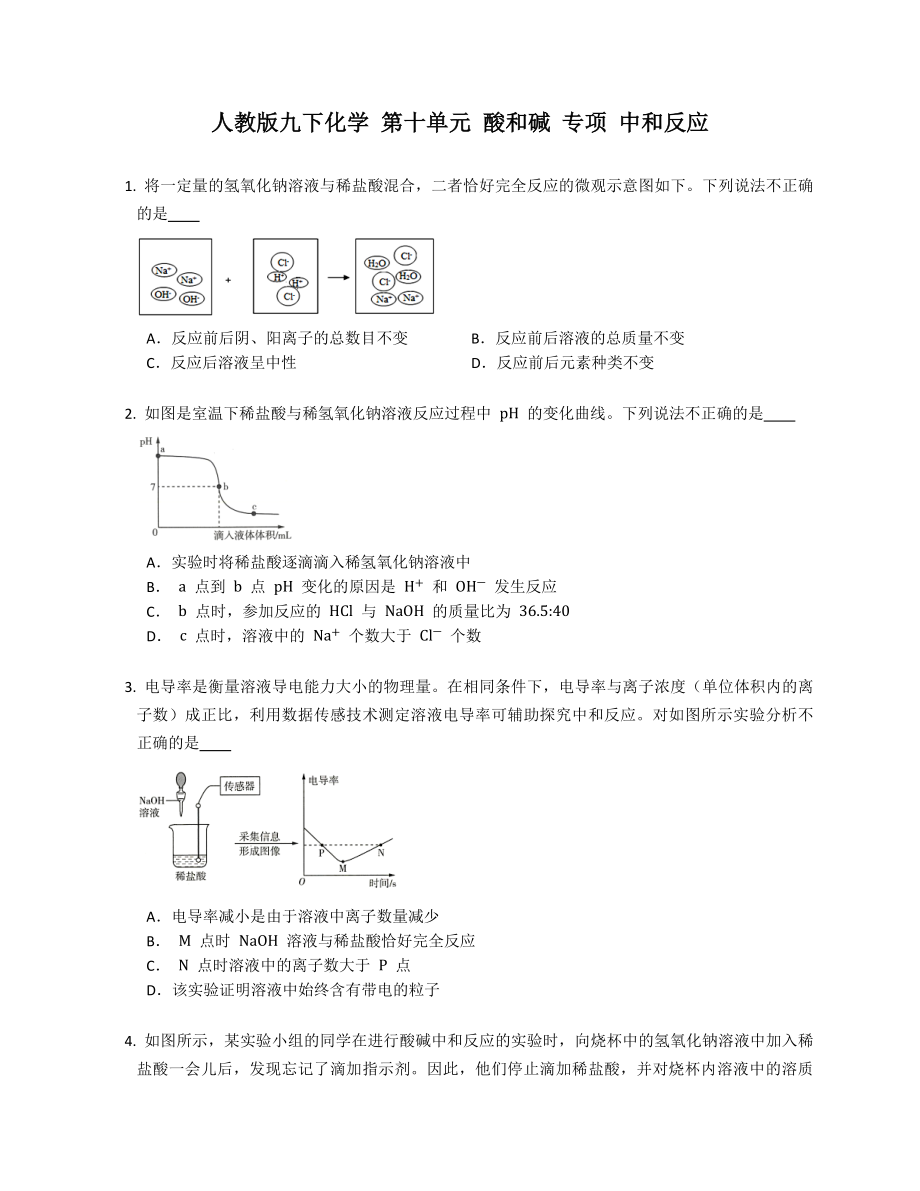
1. 將一定量的氫氧化鈉溶液與稀鹽酸混合�,二者恰好完全反應(yīng)的微觀(guān)示意圖如下���。下列說(shuō)法不正確的是
A.反應(yīng)前后陰��、陽(yáng)離子的總數(shù)目不變 B.反應(yīng)前后溶液的總質(zhì)量不變
C.反應(yīng)后溶液呈中性 D.反應(yīng)前后元素種類(lèi)不變
2. 如圖是室溫下稀鹽酸與稀氫氧化鈉溶液反應(yīng)過(guò)程中 pH 的變化曲線(xiàn)����。下列說(shuō)法不正確的是
A.實(shí)驗(yàn)時(shí)將稀鹽酸逐滴滴入稀氫氧化鈉溶液中
B. a 點(diǎn)到 b 點(diǎn) pH 變化的原因是 H+ 和 OH- 發(fā)生反應(yīng)
C. b 點(diǎn)時(shí)����,參加反應(yīng)的 HCl 與 NaOH 的質(zhì)量比為 36.5:40
2、
D. c 點(diǎn)時(shí)�����,溶液中的 Na+ 個(gè)數(shù)大于 Cl- 個(gè)數(shù)
3. 電導(dǎo)率是衡量溶液導(dǎo)電能力大小的物理量�����。在相同條件下�����,電導(dǎo)率與離子濃度(單位體積內(nèi)的離子數(shù))成正比,利用數(shù)據(jù)傳感技術(shù)測(cè)定溶液電導(dǎo)率可輔助探究中和反應(yīng)�����。對(duì)如圖所示實(shí)驗(yàn)分析不正確的是
A.電導(dǎo)率減小是由于溶液中離子數(shù)量減少
B. M 點(diǎn)時(shí) NaOH 溶液與稀鹽酸恰好完全反應(yīng)
C. N 點(diǎn)時(shí)溶液中的離子數(shù)大于 P 點(diǎn)
D.該實(shí)驗(yàn)證明溶液中始終含有帶電的粒子
4. 如圖所示���,某實(shí)驗(yàn)小組的同學(xué)在進(jìn)行酸堿中和反應(yīng)的實(shí)驗(yàn)時(shí)�����,向燒杯中的氫氧化鈉溶液中加入稀鹽酸一會(huì)兒后,發(fā)現(xiàn)忘記了滴加指示劑�����。因此����,他們停
3、止滴加稀鹽酸���,并對(duì)燒杯內(nèi)溶液中的溶質(zhì)成分進(jìn)行探究��。
(1) 從微觀(guān)角度分析��,中和反應(yīng)的實(shí)質(zhì)是 �����。
(2) 探究燒杯內(nèi)溶液中溶質(zhì)的成分:
i 【提出問(wèn)題】該燒杯內(nèi)溶液中的溶質(zhì)是什么���?
【猜想】猜想①:可能是 NaCl 和 NaOH�;
猜想②:可能只有 NaCl�;
猜想③:可能是 。
【查閱資料】氯化鈉溶液呈中性�����。
ii 【進(jìn)行實(shí)驗(yàn)】
實(shí)驗(yàn)方案實(shí)驗(yàn)操作實(shí)驗(yàn)現(xiàn)象實(shí)驗(yàn)結(jié)論方案一取少量燒杯內(nèi)溶液溶液????猜想①不于試管中,滴入幾滴????色正確酚酞溶液,振蕩方案二取少量燒杯內(nèi)溶液????猜想②不于另一支試管中,逐????正確,猜滴加入碳酸鈉溶液想③正確至過(guò)量
4����、
iii 【反思與拓展】
(1)在分析化學(xué)反應(yīng)后所得物質(zhì)成分時(shí),除考慮生成物外還需考慮 ��。
(2)根據(jù)所學(xué)化學(xué)知識(shí)��,驗(yàn)證燒杯內(nèi)溶液中的溶質(zhì)含有 HCl�����,除以上方案外,下列哪些物質(zhì)單獨(dú)使用也能完成該實(shí)驗(yàn)����? (填序號(hào))。
A. pH 試紙
B.銅
C.碳酸鈣
D.氧化銅
答案
1. 【答案】A
【解析】A.由反應(yīng)的微觀(guān)示意圖可知�����,反應(yīng)前有 4 個(gè)陽(yáng)離子�����、 4 個(gè)陰離子���,而反應(yīng)后有 2 個(gè)陽(yáng)離子、 2 個(gè)陰離子����,反應(yīng)后陰、陽(yáng)離子的總數(shù)減少����,此選項(xiàng)錯(cuò)誤;
B.此反應(yīng)過(guò)程中無(wú)氣體和沉淀生成�����,根據(jù)質(zhì)量守恒定律,反應(yīng)前后溶液的總重量質(zhì)量不變�����,此選項(xiàng)正確�����;
C.根據(jù)反
5����、應(yīng)的微觀(guān)示意圖可知,反應(yīng)前后溶液中含有氯化鈉和水兩種物質(zhì)����,氯化鈉溶液呈中性,所以反應(yīng)后的溶液呈中性���,此選項(xiàng)正確����;
D.化學(xué)反應(yīng)前后元素種類(lèi)不變����,此選項(xiàng)正確����。
故選A���。
2. 【答案】D
【解析】由題圖可知�,開(kāi)始時(shí)溶液顯堿性�,最后溶液顯酸性,所以是將稀鹽酸滴入稀氫氧化鈉溶液中��,A正確����;a 點(diǎn)到 b 點(diǎn)時(shí),溶液由堿性變?yōu)橹行?����,?shí)質(zhì)是酸中的 H+ 和堿中的 OH- 結(jié)合生成了水��,B正確��;b 點(diǎn)時(shí)氫氧化鈉和稀鹽酸恰好完全反應(yīng)��,依據(jù)化學(xué)方程式“NaOH+HCl=NaCl+H2O”可得出參加反應(yīng)的 HCl 和 NaOH 的質(zhì)量比為 36.5:40����,C正確;c 點(diǎn)時(shí)�,稀鹽酸過(guò)量,溶液中 Cl-
6�、 的個(gè)數(shù)大于 Na+ 的個(gè)數(shù),D不正確�。
3. 【答案】A
【解析】由題干信息“在相同條件下,電導(dǎo)率與離子濃度(單位體積內(nèi)的離子數(shù))成正比”可知���,電導(dǎo)率減小不是由于溶液中離子數(shù)量減少�����,而是由于離子濃度減小��,A錯(cuò)誤���;M 點(diǎn)時(shí)溶液的電導(dǎo)率最小,即溶液中離子濃度最小��,即 NaOH 溶液與稀鹽酸恰好完全反應(yīng),B正確���;N 點(diǎn)時(shí)溶液的電導(dǎo)率與 P 點(diǎn)時(shí)相同��,但是 N 點(diǎn)時(shí)溶液的體積大于 P 點(diǎn)時(shí)溶液的體積����,說(shuō)明 N 點(diǎn)時(shí)溶液中的離子數(shù)大于 P 點(diǎn)����,C正確;在該反應(yīng)過(guò)程中��,溶液始終具有導(dǎo)電性��,即該實(shí)驗(yàn)證明溶液中始終含有帶電的粒子��,D正確����。
4. 【答案】
(1) 氫離子和氫氧根離子結(jié)合生成水分子(或 H++OH-=H2O)
(2) i NaCl 、 HCl
ii 不變���;有氣泡產(chǎn)生
iii 反應(yīng)物是否過(guò)量;ACD
 人教版九年級(jí)下學(xué)期化學(xué) 第十單元 酸和堿 專(zhuān)項(xiàng) 中和反應(yīng)
人教版九年級(jí)下學(xué)期化學(xué) 第十單元 酸和堿 專(zhuān)項(xiàng) 中和反應(yīng)