《【作業(yè)表單】體現(xiàn)學(xué)科核心素養(yǎng)的教學(xué)設(shè)計(2)》由會員分享�,可在線閱讀,更多相關(guān)《【作業(yè)表單】體現(xiàn)學(xué)科核心素養(yǎng)的教學(xué)設(shè)計(2)(8頁珍藏版)》請在裝配圖網(wǎng)上搜索��。
1�、體現(xiàn)學(xué)科核心素養(yǎng)的教學(xué)設(shè)計
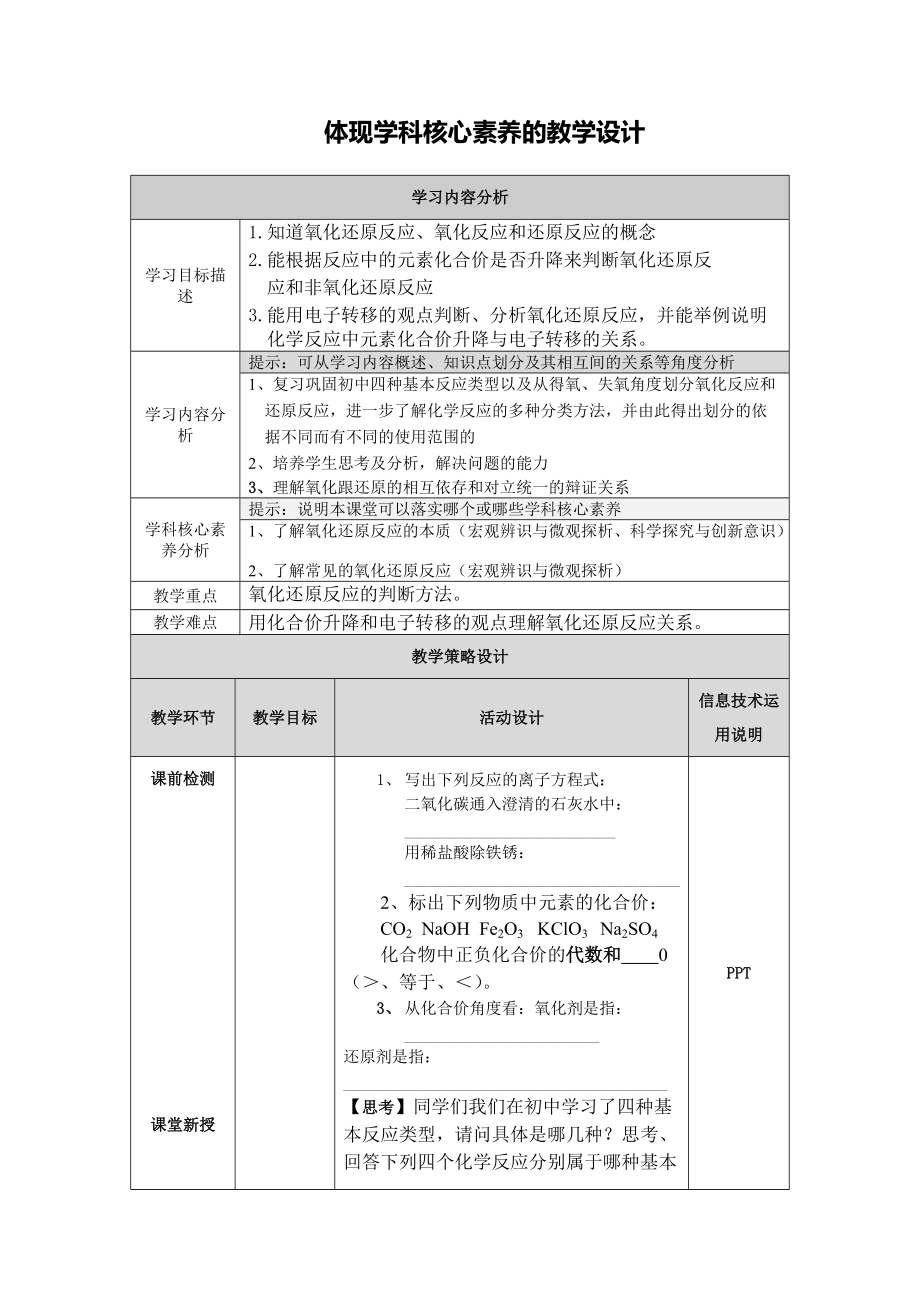
學(xué)習(xí)內(nèi)容分析
學(xué)習(xí)目標(biāo)描述
1.知道氧化還原反應(yīng)、氧化反應(yīng)和還原反應(yīng)的概念
2.能根據(jù)反應(yīng)中的元素化合價是否升降來判斷氧化還原反
應(yīng)和非氧化還原反應(yīng)
3.能用電子轉(zhuǎn)移的觀點判斷�����、分析氧化還原反應(yīng)�,并能舉例說明化學(xué)反應(yīng)中元素化合價升降與電子轉(zhuǎn)移的關(guān)系。
學(xué)習(xí)內(nèi)容分析
提示:可從學(xué)習(xí)內(nèi)容概述、知識點劃分及其相互間的關(guān)系等角度分析
1�、復(fù)習(xí)鞏固初中四種基本反應(yīng)類型以及從得氧、失氧角度劃分氧化反應(yīng)和還原反應(yīng)��,進一步了解化學(xué)反應(yīng)的多種分類方法��,并由此得出劃分的依據(jù)不同而有不同的使用范圍的
2���、培養(yǎng)學(xué)生思考及分析���,解決問題的能力
3、理解氧化跟還原的相互依
2��、存和對立統(tǒng)一的辯證關(guān)系
學(xué)科核心素養(yǎng)分析
提示:說明本課堂可以落實哪個或哪些學(xué)科核心素養(yǎng)
1����、 了解氧化還原反應(yīng)的本質(zhì)(宏觀辨識與微觀探析、科學(xué)探究與創(chuàng)新意識)
2���、 了解常見的氧化還原反應(yīng)(宏觀辨識與微觀探析)
教學(xué)重點
氧化還原反應(yīng)的判斷方法��。
教學(xué)難點
用化合價升降和電子轉(zhuǎn)移的觀點理解氧化還原反應(yīng)關(guān)系���。
教學(xué)策略設(shè)計
教學(xué)環(huán)節(jié)
教學(xué)目標(biāo)
活動設(shè)計
信息技術(shù)運用說明
課前檢測
課堂新授
3���、
課堂檢測
課后作業(yè)
1、 寫出下列反應(yīng)的離子方程式:
二氧化碳通入澄清的石灰水中:__________________________
用稀鹽酸除鐵銹:__________________________________
2�、標(biāo)出下列物質(zhì)中元素的化合價:
CO2 NaOH Fe2O3 KClO3 Na2SO4
化合物中正負化合價的代數(shù)和
4��、 0 (>���、等于�����、<)�。
3��、 從化合價角度看:氧化劑是指:________________________
還原劑是指:________________________________________
【思考】同學(xué)們我們在初中學(xué)習(xí)了四種基本反應(yīng)類型�����,請問具體是哪幾種����?思考、回答下列四個化學(xué)反應(yīng)分別屬于哪種基本反應(yīng)類型����?
反應(yīng)類型
實例
表示式
C+O2
點燃
CO2
A+B+…
AB
CaCO3
高溫
CaO+CO2↑
AB
A+B+…
C+2CuO
高溫
2Cu+CO2↑
A+BC
5���、
AC+B
CaCO3+2HCl
CaCl2+CO2+H2O↑
AB+CD
AD+CB
【小組討論】下列反應(yīng)屬于哪種基本反應(yīng)類型?
Fe2O3+3CO
高溫
2Fe+3CO2
【自主學(xué)習(xí)】閱讀課本P35�����、P36�����、P37(前兩段)的內(nèi)容��,填空�。
1、氧化還原反應(yīng):
是氧化反應(yīng)�。
是還原反應(yīng)。
反應(yīng)前后�,元素化合價 的化學(xué)反應(yīng)是氧化
6、還原反應(yīng)�。
元素化合價 的化學(xué)反應(yīng)都是非氧化還原反應(yīng)。
2����、氧化還原反應(yīng)的實質(zhì):
⑴化合價升高�����,該元素原子在反應(yīng)中 (“得”還是“失”)電子或電子對發(fā)生 (“偏離”還是“偏向”)����,被 (“氧化”還是“還原”)�����,該物質(zhì)發(fā)生 反應(yīng)����;
化合價降低��,該元素原子在反應(yīng)中 (“得”還是“失”)電子或電子對發(fā)生 (“偏離”還是“偏向”)�,被 (“氧化”還是“還原”),該物質(zhì)發(fā)生 反應(yīng)�����。
⑵氧化還原反應(yīng)的本質(zhì):反應(yīng)過程中有電子 (
7�、或 )。
【思考交流】我們再來思考Fe2O3+3CO
高溫
2Fe+3CO2屬于何種反應(yīng)類型����?依據(jù)什么�����?
【例題1】下列反應(yīng)屬于氧化還原反應(yīng)的是 ( D)
A��、CaCO3+2HCl
CaCl2+H2O+CO2↑
B�����、Na2O+H2O
2NaOH
C���、CaCO3
高溫
CaO+CO2↑
D、Mg+2HCl
MgCl2+H2↑
【變式題1】判斷下列反應(yīng)中哪些是氧化還原反應(yīng)?(A D E F)
A. C+O2
點燃
CO2 B
8���、. CaO+H2O
Ca(OH)2
C. Cu(OH)2
△
CuO+H2O D. 2KClO3
加熱
2KCl+3O2↑
E. Zn+H2SO4
ZnSO4+H2↑ F . H2+CuO
加熱
Cu+H2O
G. NaOH+HCl
NaCl+H2O H. Na2SO4+BaCl2
BaSO4↓+2NaCl
【小組討論】參考變式題1���,總結(jié)氧化還原反應(yīng)與四種基本反應(yīng)類型的關(guān)系。
化合反應(yīng)
氧化還原反應(yīng)
分解反應(yīng)
化學(xué)反應(yīng)
置換反應(yīng)
基
9�、本反應(yīng)類型
非氧化還原反應(yīng)
復(fù)分解反應(yīng)
【投影】用圖形表示氧化還原反應(yīng)與四種基本反應(yīng)類型的關(guān)系
【例題2】下列反應(yīng)中,既是化合反應(yīng)又是氧化還原反應(yīng)的是 ( B )
A.2H2S+SO2
3S+2H2O B.2NO+O2
2NO2
C.4NH3+5O2
4NO+6H2O D.SO2+H2O
H2SO3
【變式題2】下列四種基本類型的反應(yīng)中�,一定是氧化還原反應(yīng)的是 ( C )
A.化合反應(yīng) B.分解反應(yīng) C.置換反應(yīng)
10、D.復(fù)分解反應(yīng)
【觀看動畫】理解氧化還原反應(yīng)的實質(zhì)
【例題3】有關(guān)氧化還原反應(yīng)實質(zhì)的說法中正確的是 ( A )
A.是否有元素的電子轉(zhuǎn)移
B.是否有元素的化合價的變化
C.是否有氧元素的參加
D.是否有原子的重新組合
【變式題3】下列有關(guān)氧化還原反應(yīng)的說法正確的是 ( B )
A.氧化還原反應(yīng)的實質(zhì)是化合價發(fā)生了變化
B.所含元素化合價升高的反應(yīng)是氧化反應(yīng)
C.得到電子的物質(zhì)被氧化
D.氧化還原反應(yīng)中�����,先發(fā)生氧化后發(fā)生還原
【總結(jié)提升】
1.定義:有元素化合價升降或有電子轉(zhuǎn)移(得失或偏移)的化學(xué)反應(yīng)。
11�、特征:化合價升降;本質(zhì):電子轉(zhuǎn)移��。
2.氧化還原反應(yīng)與四種基本反應(yīng)的聯(lián)系
3.口訣:
升(化合價升高)→失(失電子)→氧(被氧化或發(fā)生氧化反應(yīng))
降(化合價降低)→得(得電子)→還(被還原或發(fā)生還原反應(yīng))
1�、氧化還原反應(yīng)的實質(zhì) ( D )
A、氧元素的得失 B����、氫元素的得失 C����、元素化合價的升降 D、電子的轉(zhuǎn)移
2.下列反應(yīng)中��,屬于氧化還原反應(yīng)���,但不屬于置換反應(yīng)的是 ( A )
A.FeO+CO
高溫
Fe+CO2 B.Na2CO3+Ca(OH
12��、)2
CaCO3↓+2NaOH
C.CaCO3
高溫
CaO+CO2 D.C+O2
點燃
CO2
3����、下列關(guān)于化學(xué)反應(yīng)的說法中正確的是 ( B )
A .化合反應(yīng)一定是氧化還原反應(yīng) B.有單質(zhì)生成的分解反應(yīng)一定是氧化還原反應(yīng)
C.置換反應(yīng)有可能是氧化還原反應(yīng) D.復(fù)分解反應(yīng)不一定是氧化還原反應(yīng)
4、根據(jù)下列物質(zhì)變化中化合價的情況��,判斷屬于還原反應(yīng)的是 ( ACD )
A. CuO → Cu B. NaCl → HCl
C. C → CO2
13��、 D. FeCl2 → FeCl3
補充練習(xí)�、
預(yù)習(xí): 1.如何單線橋、雙線橋表示電子轉(zhuǎn)移的方向和數(shù)目��?
2.試用單線橋����、雙線橋表示 Mg+2HCl
MgCl2+H2↑電子轉(zhuǎn)移的方向和數(shù)目
PPT
分層作業(yè)題
1.下列反應(yīng)是氧化還原反應(yīng)的是( B )
A.CaCO3CaO+CO2↑
B.CH4+2O22H2O+CO2
C.Na2CO3+2HCl===2NaCl+H2O+CO2↑
D.2NaOH+H2SO4===Na2SO4+2H2O
2.日常生活中的許多現(xiàn)象與化學(xué)反應(yīng)有關(guān),下列現(xiàn)象與氧化還原反應(yīng)無關(guān)的是( C )
A.銅器出現(xiàn)銅綠[Cu2(OH)
14�����、2CO3]
B.鐵制菜刀生銹
C.大理石雕像被酸雨腐蝕毀壞
D.鋁鍋表面生成致密的氧化鋁薄膜
3.下列反應(yīng)屬于氧化還原反應(yīng)�,但不屬于置換反應(yīng)的是( A )
A.2KMnO4+16HCl(濃)===2KCl+2MnCl2+5Cl2↑+8H2O
B.Cl2+2KI===2KCl+I2
C.NaCl(固)+H2SO4(濃)===NaHSO4+HCl↑
D.Fe+CuSO4===FeSO4+Cu
4.下列有關(guān)氫氣的說法正確的是( C )
A.在2H2+O2===2H2O反應(yīng)中,氫氣發(fā)生了還原反應(yīng)
B.在Zn+2H+===Zn2++H2↑反應(yīng)中��,氫氣是H+發(fā)生氧化反應(yīng)生成的產(chǎn)物
15���、C.在H2+CuO===Cu+H2O反應(yīng)中���,氫氣發(fā)生了氧化反應(yīng)
D.在H2+2Na===2NaH反應(yīng)中��,氫氣發(fā)生了氧化反應(yīng)
5.氧化反應(yīng)和還原反應(yīng)發(fā)生在同種元素之間的是( B )
A.Zn+2HCl===ZnCl2+H2↑
B.2H2S+SO2===3S↓+2H2O
C.H2+CuO===Cu+H2O
D.2H2O2H2↑+O2↑
6.化學(xué)反應(yīng)按照不同的分類方法����,可以分為化合��、分解���、置換��、復(fù)分解����,或者分為氧化還原反應(yīng)和非氧化還原反應(yīng)���。有下列一組反應(yīng):
①CO2+C2CO
②Cu2(OH)2CO3===2CuO+H2O+CO2↑
③2NaOH+Cl2===NaCl+NaClO
16、+H2O
④2CO+O22CO2
⑤3Fe+4H2O(g)Fe3O4+4H2
⑥CuO+CO===Cu+CO2
⑦4NH3+3O2(純)2N2+6H2O
⑧2H2O2H2↑+O2↑
⑨2Al+2NaOH+2H2O===2NaAlO2+3H2↑
⑩SO2+H2O===H2SO3
?H2O2+SO2===2H++SO
(1)其中屬于化合反應(yīng)的有_______�����,屬于置換反應(yīng)的有_______�。
(2)在化學(xué)反應(yīng)前后元素的化合價沒有變化的是________。
(3)上述反應(yīng)中���,既是分解反應(yīng)又是氧化還原反應(yīng)的是________����。
(4)上述反應(yīng)中,既是溶液中的離子反應(yīng)�,又是氧化還原反應(yīng)的是________。
(5)根據(jù)你的理解�,氧化還原反應(yīng)的實質(zhì)是________。
A.分子中的原子重新組合
B.氧元素的得失
C.電子的得失或共用電子對的偏移
D.化合價的改變
(6)根據(jù)反應(yīng)?����,你認為離子反應(yīng)發(fā)生的條件應(yīng)該怎樣補充?
_____________________________________________________���。
答案:(1)①④⑩??��、茛摺?2)②⑩ (3)⑧ (4)③⑨? (5)C (6)溶液中有離子參加或生成的氧化還原反應(yīng)一定是離子反應(yīng)
 【作業(yè)表單】體現(xiàn)學(xué)科核心素養(yǎng)的教學(xué)設(shè)計(2)
【作業(yè)表單】體現(xiàn)學(xué)科核心素養(yǎng)的教學(xué)設(shè)計(2)